|
AMM重磅综述|基于MDM2配基的蛋白靶向降解剂
作者:ISE 来源: 时间:2022-08-05 访问量: 1338 |
|
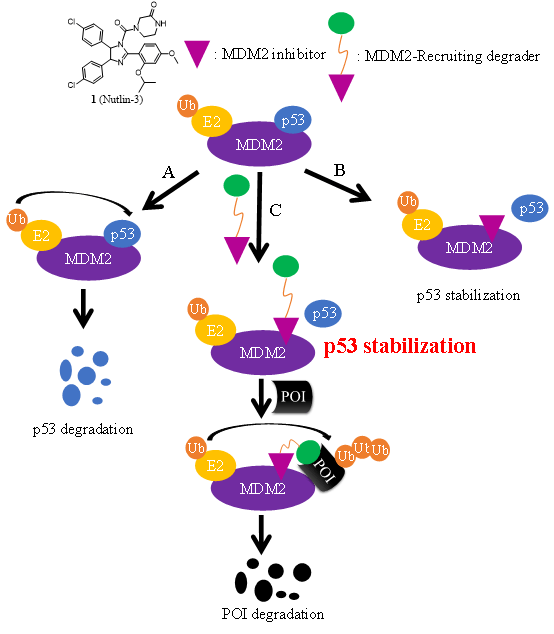
近日,浙江大学医学院韩欣研究员和孙毅教授团队及哈佛大学医学院魏文毅教授在Acta Materia Medica上发表了题为"PROTAC Degraders with Ligands Recruiting MDM2 E3 Ubiquitin Ligase: An Updated Perspective" 的综述论文(doi.org/10.15212/AMM-2022-0010)。 促癌基因MDM2是一种靶向p53的负调控因子,促进p53泛素化降解。MDM2通过三种机制阻断p53: 1)MDM2直接结合p53的转录激活域,抑制p53介导的转录活性; 2)MDM2核输出信号序列结合后诱导p53核输出,从而阻止p53结合靶DNA; 3)最有效的机制是,MDM2作为E3泛素连接酶促进p53的泛素化降解。因此,阻断MDM2-p53相互作用已成为发现和开发高效MDM2抑制剂的有效策略。
近几年,蛋白靶向降解PROTAC领域得到了快速的发展,在通过诱导靶向蛋白降解发现和开发新型小分子疗法方面显示出了明显的优势。 PROTAC分子由三部分组成:1)一个小分子,专门结合目标蛋白;2)另一个小分子或肽作为E3配体与E3连接酶结合;3)化学连接器将前两部分连接起来。迄今为止,PROTAC技术已被成功用于靶向降解各种蛋白质,包括转录因子、骨架蛋白、核受体、酶和调控蛋白,在癌症治疗中表现出来明显的优越性,代表性化合物为PROTAC先驱Arvinas公司开发的临床降解剂ARV-110和ARV-471。 在这篇综述中,作者归纳总结了MDM2抑制剂如何用于构建几种基于MDM2的PROTAC降解剂,1)阻断MDM2-p53结合,从而稳定p53;2)作为PROTAC的E3配体组分,用于降解其他靶向致癌蛋白。
我们知道,人体内有超过600中E3连接酶,而用于PROTAC技术且有配体的仅有10多个,代表性像VHL、CEBN、MDM2等,这也是目前PROTAC技术的一大挑战,亟需开发新型高效的E3连接酶配体,以扩充PROTAC技术在蛋白降解类药物研发中的应用。 第一作者/通讯作者介绍 韩欣,浙江大学医学院附属第二医院特聘研究员,转化医学研究院“化学小分子药物研发平台”负责人,Acta Materia Medica和Cancer Innovation青年编委,专注于原创性小分子药物的开发与转化。2007年-2016年本/硕博毕业于武汉大学药学院,导师是周海兵教授和董春娥教授;2016年-2021年在国际著名药物化学家、《Journal of Medicinal Chemistry》前主编、美国密歇根大学医学院王少萌教授实验室从事博士后研究。 前期主要围绕抗肿瘤和抗病毒小分子药物进行研究,尤其是在PROTAC抗肿瘤药物研发领域,取得了一系列较为重要的成果。研究工作已发表高水平SCI论文26篇,其中第一作者和共同第一作者论文18篇,药物化学顶级Top1期刊J. Med. Chem. 8篇(其中ESI高被引论文3篇、Faculty Opinions(原F1000Prime)推荐2篇、Highlight论文1篇)。作为主要贡献者和参与者完成多个PROTAC项目(AR降解剂、BRD4降解剂、MDM2降解剂等)的临床前评价,拥有1个临床候选化合物。获得国内外专利17项(国际专利12项,导师外第一发明人9项),其中10项转让给美国Roivant Science和中国亚盛医药,金额达1亿美元。 共同作者
魏文毅教授现为美国哈佛大学医学院终身教授,著名肿瘤生物学家,长期从事肿瘤生物学的基础研究和肿瘤防治研究工作,在蛋白质泛素化和降解领域处于世界领先水平。在Science、Nature、Cell、Cancer Cell、Nature Cell Biology、Cancer Discovery、Molecular Cell、Nature Reviews Cancer等国际顶级期刊发表论文150余篇,被引频次超过14000次。 通讯作者
孙毅,浙江大学求是讲席教授, 双聘浙江大学医学院附属第二医院和浙江大学转化医学研究院,兼任浙江大学滨江研究院生命与大健康研究中心副主任;浙江大学转化医学研究院创始院长、美国科学促进会(AAAS)会士、原美国密歇根大学放射肿瘤学系冠名终身教授。 孙毅教授实验室长期从事恶性肿瘤发生发展的分子机制,分子标志物/抗肿瘤分子靶点鉴定以及小分子抗癌药物开发的研究工作,主要利用分子、生化、细胞生物学等技术手段和条件基因敲除鼠模型研究Cullin-RING ligase泛素连接酶和蛋白拟素化修饰在肿瘤发生发展中的作用及抗肿瘤靶向药物研发。目前正在研发CRL E3连接酶和拟素化通路的小分子抑制剂。孙毅教授的工作以通讯作者发表于Dev Cell, JCI, Mol Cell, Nature Communs, PNAS, Science Adv.等国际权威杂志;发表论文累计250多篇,H指数73,累计引用次数 >28500次,连续多年入选爱思唯尔中国高被引学者。获得授权国际国内专利10项,相关研究获得多项国内外科研基金资助;为国家重点研发计划项目、国家自然科学基金重点项目负责人。 Acta Materia Medica是一本由爱尔兰Compuscript出版社出版的金色开源(Gold open access)英文期刊(https://amm-journal.org/),国际标准期刊号(ISSN):2737-7946。该刊旨在快速报道国际药学领域的最新前沿成果,推动全球药学领域的知识共享,打造国际一流药学期刊和药学领域科学共同体建设平台。 现有来自全球著名学术机构的49位学者担任编委,其中中国17人、美国18人、日本4人、丹麦2人、德国1人、英国3人、澳大利亚1人、新西兰1人、芬兰1人、匈牙利1人。 Acta Materia Medica 由上海中医药大学首席教授徐宏喜和美国哈佛大学医学院终身教授魏文毅担任共同主编,华中科技大学同济药学院李华教授担任执行主编。 |

 English
English 日本語
日本語 电话:0512-67621565
电话:0512-67621565 邮箱:info@iseediting.com
邮箱:info@iseediting.com





 写作技巧
写作技巧