导读——
新药从研发到上市需要经过层层考验,早期临床试验是药物研发进入临床的关键一步。
早期临床试验涉及了临床医学、药理学、药代动力学、药剂学等众多学科,决定了药物是否开展更大型的临床试验或直接上市。系统化的临床试验能够高效、准确评估药物的安全性和有效性,是帮助药物尽快进入临床应用,解决患者病痛的重要一环。
主要内容
Main content
随着现代社会的进步,人类饮食结构在数百年间发生了质的变化,生活质量显著提升,同时伴随着疾病风险的增加。例如,痛风作为古代的“富贵病”,近年来却逐渐“平民化”和“年轻化”。目前,治疗痛风和高尿酸血症的药物较少,且存在一定的个体差异和治疗风险。例如,使用别嘌醇的患者可能发生严重的过敏反应,其原因之一是这部分患者携带易致敏的HLA-B*5801基因型,而亚洲人群携带这种基因的比例较高。人种差异和遗传背景差异是影响药物安全性和有效性的重要因素,往往难以预测,需要早期临床试验进行确证。近年,日本富士药业研发了新的降尿酸药物——Topiroxostat(托吡司特),其作为一款新的黄嘌呤酶抑制剂,能够安全、有效治疗高尿酸血症和痛风。目前该药已在日本上市。然而,Topiroxostat在中国人群中的应用安全性和有效性仍是未知数。
近期,BIO Integration 最新上线了一篇Clinical Trial“A Phase I, Randomized, Single Ascending-Dose, Multiple-Dose, and Food-Effect Trial of the Safety, Efficacy, and Pharmacokinetics of Topiroxostat in Healthy Chinese Participants”,作者是来自中国中山大学孙逸仙纪念医院的叶穗雯、姚和瑞、伍俊妍等人。作者设计了一项随机、单剂量爬坡、多剂量和食物影响的药代动力学试验,研究了Topiroxostat在中国健康人中的药代动力学特征和初步的安全性及有效性。作者巧妙开展临床试验设计,共享食物影响组和单剂量爬坡组的受试者数据,从尽可能少的受试者中获得最充分的临床数据。

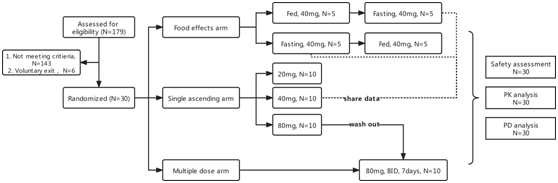
本临床试验的研究设计
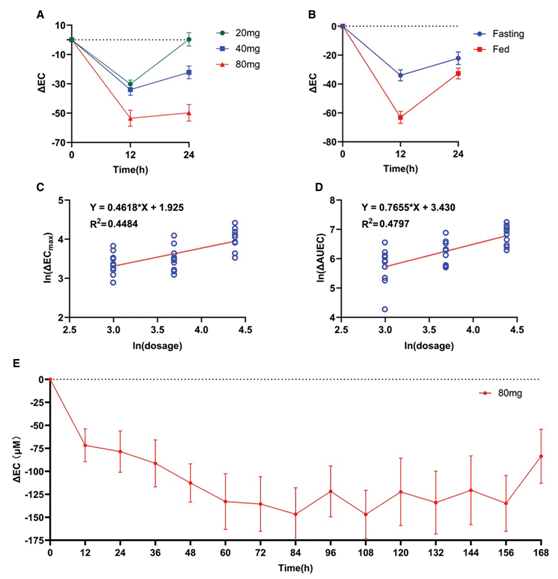
试验结果显示,Topiroxostat在中国人群中的安全性好,具有口服吸收迅速、起效快、多次给药3天后即可长期稳定控制尿酸水平等优点。通过详细分析临床试验数据,作者发现Topiroxostat适合每日给药和餐后服药。同时,对比日本人群,两者的药代动力学特征无显著差异。该临床试验为Topiroxostat进入中国市场提供了宝贵的临床数据,为将来Topiroxostat的临床应用提供了重要的用药参考。
临床试验结果。A)单次给药不同剂量的降尿酸作用;B)饮食对降尿酸作用的影响;C,D)剂量与降尿酸作用的线性关系;E)多次给药尿酸水平变化
作者指出,目前国内可选的降尿酸药物主要有别嘌醇、苯溴马隆、非布司他。别嘌醇具有过敏风险和用药前检测HLA-B*5801的必要性,苯溴马隆因肝毒性在欧洲退市,而非布司他FDA黑框警告其具有增加心血管事件死亡的风险。虽然这些药物具有很好的降尿酸作用,但其同样伴随着不同的风险。Topiroxostat未来在中国上市,将有望与现有药物形成互补,使更多的患者有药可医,具有重要的临床意义。
引用方式:Suiwen Ye, Wei Zhuang, Yunni Lin, Xiuping Lai, Junyi Chen, Jing Wang, Guoping Zhong, Herui Yao and Junyan Wu. A Phase I, Randomized, Single-Ascending-Dose, Multiple-Dose, and Food-Effect Trial of the Safety, Efficacy, and Pharmacokinetics of Topiroxostat in Healthy Chinese Participants. BIO Integration 2022.
原文链接:
https://bio-integration.org/10-15212-bioi-2022-0006/
|

